BioXgel
BioXgel es un desarrollo tecnológico basado en los componentes presentes en nuestro plasma, que contiene una alta concentración de plaquetas (también denominado PRP, plasma rico en plaquetas). BioXgel es un producto biológico derivado del plasma autólogo (del mismo paciente), que puede combinar componentes bioactivos derivados de plasma/plaquetas, conteniendo una alta concentración de plaquetas, rico en proteínas plasmáticas y una gran cantidad de factores de crecimiento plaquetarios.
Los PRP son productos que se utilizan de forma segura en aplicaciones clínicas debido al procedimiento de aplicación mínimamente invasivo, su perfil de seguridad y la facilidad de obtención.
Las terapias celulares autólogas modernas que utilizan aplicaciones de PRP tienen el potencial de desempeñar funciones complementarias en una variedad de tratamientos de medicina regenerativa. La terapia PRP está basada en el hecho de que los factores de crecimiento plaquetario (PGF) apoyan las tres fases de la cicatrización de heridas y fomentan la cascada de reparación (inflamación, proliferación, remodelación).
En los últimos años, el PRP ha surgido como un tratamiento biológico autólogo prometedor para el uso en medicina estética y regenerativa. El PRP contiene proteínas bioactivas, incluidas factores de crecimiento, péptidos y citocinas que estimulan la cicatrización de la piel y los tejidos blandos.
En particular, las características de BioXgel incluyen:
- Concentración de plaquetas de diez a quince veces respecto al conteo basal.
- Concentraciones casi nulas de eritrocitos y leucocitos.
- Adición y activación con iones que garantizan una mejor activación plaquetaria.
En nuestras instalaciones, para la preparación de BioXgel, contamos con una toma de muestras habilitada por la Dirección Seccional de Salud de Antioquia (DSSA) y con un Banco de Células que cumple con las disposiciones adaptadas a buenas prácticas de manufactura (GMP, Good Manufacturing Practice, por sus siglas en inglés), en donde realizamos los procedimientos en ambientes controlados (cabina de flujo laminar clase II tipo A2-ISO5) y con controles microbiológicos de muestras, ambientes y operarios, trabajando siempre con los más altos estándares de calidad.
Además, los equipos utilizados en nuestros procedimientos para la obtención y formulación del BioXgel son de última tecnología y son los utilizados en los mejores laboratorios a nivel mundial tanto en investigación básica como aplicada. En nuestra clínica y en nuestro banco de células contamos con un equipo profesional y científico altamente capacitado y formado para el direccionamiento, control y procesamiento de las muestras, doctores en biotecnología y ciencias básicas biomédicas, magister en biomedicina y especialistas en calidad.
Además, en BioXcellerator contamos con un grupo de investigación (Terapia Celular y Medicina Traslacional, registrado ante Colciencias), en donde realizamos investigación básica y clínica, con protocolos estandarizados y estamos enfocados en una constante búsqueda del conocimiento en pro de mejorar nuestros procesos para ofrecer las mejores alternativas terapéuticas avanzadas para el tratamiento de diferentes patologías.
Las plaquetas son la interfaz entre los procesos inflamatorios y regenerativos. Su principal función es adherirse, agregarse y secretar una amplia variedad de metabolitos y proteínas con diversas actividades biológicas. Además, son responsables de potenciar las respuestas de reparación/regeneración celular.
La concentración normal de plaquetas en sangre humana oscila entre 150.000 y 400.000/mL. Los sistemas de PRP a base de plasma suelen contener una concentración de plaquetas entre el valor inicial y el triple del valor inicial (menor o igual a 750.000 plaquetas/mL). Por otro lado, los sistemas basados en la capa leucocitaria producen una concentración de plaquetas tres veces superior, en un rango de cuatro a seis veces (más de 750.000 plaquetas/mL hasta 1.800.000 plaquetas/mL).
Los estudios in vitro, in vivo y clínicos han demostrado resultados satisfactorios para las formulaciones de PRP con concentraciones de plaquetas moderadas (dos y tres veces el valor normal) y altas (cuatro a seis veces). Se ha demostrado que el mejor efecto angiogénico del PRP se obtiene con 1.500.000 plaquetas/mL, subrayando así el papel de las concentraciones plaquetarias en la aplicación clínica cuando el aumento de la angiogénesis contribuye al proceso de curación.
Sin embargo, una concentración de plaquetas superior a seis veces lo normal (> 1.800.000 plaquetas/mL) puede ser perjudicial o tener efectos secundarios; además, una cantidad excesiva de plaquetas puede provocar apoptosis celular, regulación a la baja y desensibilización de los receptores del factor de crecimiento, lo que resulta en un efecto inhibidor paradójico.
El PRP libera factores de crecimiento (GF) y proteínas que se almacenan en los gránulos alfa de las plaquetas y se liberan mediante la activación de las plaquetas. Se han identificado más de 300 proteínas en la liberación de plaquetas. Se ha sugerido que el factor de crecimiento derivado de plaquetas (PDGF), el factor de crecimiento transformante beta (TGF-beta), el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento similar a la insulina (IGF) y el factor de crecimiento epidérmico (EGF) son los más importantes implicados en la reparación de tejidos a partir del PRP.
En las preparaciones de PRP, aproximadamente el 70% de los factores de crecimiento plaquetario se secretan dentro de los primeros 10 min después de la activación, y casi el 95% dentro de la primera hora. Las plaquetas pueden seguir produciendo pequeñas cantidades de factores de crecimiento durante la vida residual (8 a 10 días). Por el contrario, la PRF presenta una liberación a largo plazo más intensa, lenta y constante, hasta 5-7 días. Junto con las plaquetas, los leucocitos también contribuyen a la liberación de algunos factores de crecimiento.
- El PRP es un biológico que puede combinar componentes bioactivos derivados de plasma y plaquetas (citocinas, quimiocinas, factores de crecimiento y enzimas) con la proteína formadora de fibrina, capaz de crear una matriz regenerativa natural en el tejido afectado, densa y estable. Esto permite la liberación de biomoléculas por un grupo concentrado de plaquetas activadas al sitio de la lesión del tejido objetivo, contribuyendo así a la modulación del proceso inflamatorio, la angiogénesis y la respuesta inmune, además de promover la curación y reparación de los tejidos lesionados. Además, se ha reconocido que los productos biológicos derivados de la sangre tienen efectos antimicrobianos, como la capacidad de inhibir y / o inactivar diferentes cepas bacterianas.
- El PRP es una de esas terapias biológicas que está ganando una popularidad cada vez mayor, especialmente para el tratamiento de la osteoartrosis. El uso del PRP se informó por primera vez para uso terapéutico a fines de la década de 1980.
- Se ha demostrado que el PRP libera citocinas y factores de crecimiento en el área enferma después de un proceso de desgranulación, lo que estimula y promueve un entorno favorable para los procesos de curación de los tejidos blandos, primero con una acción proinflamatoria inicial, la cual es seguida de una reducción de las moléculas inflamatorias. Los condrocitos (células del cartílago) tratados con PRP in vitro han demostrado estimular el metabolismo de la matriz del cartílago articular y la síntesis de colágeno, resultando en similitudes histológicas y biomecánicas del tejido resultante con el tejido original.
- Con respecto a la bioactividad del PRP, se ha documentado que este contiene más de 800 proteínas que experimentan reacciones para varios factores bioactivos. Además de sus efectos coagulantes y reguladores de la inflamación, las plaquetas también desempeñan un papel en la liberación de moléculas activas y una amplia variedad de factores de crecimiento. Por lo tanto, es posible que el PRP tenga acciones fisiológicas de reparación diferentes, tales como remodelado óseo o vascular, modulación de la respuesta a la inflamación, angiogénesis, síntesis de proteínas de la matriz extracelular como el colágeno o incluso diferenciación celular. También se ha evidenciado que promueve la formación de hueso al cooperar con otros factores de crecimiento para inducir la migración de células específicas de la médula ósea.
- Múltiples investigaciones respaldan el uso de inyecciones de PRP intraarticular para promover un entorno favorable para la curación del tejido articular y retrasar la progresión de la osteoartrosis. Especialmente se ha demostrado que la terapia con PRP puede ser beneficiosa y segura para estos pacientes en el seguimiento a medio plazo.
- La aplicación clínica de estos productos biológicos en patologías musculoesqueléticas se basa en su capacidad para modular el entorno articular y su función beneficiosa para reducir la inflamación local y promover el anabolismo del cartílago y la membrana sinovial.
- En la piel, el PRP es capaz de inducir un incremento en el grosor epidérmico, la formación de crestas intercelulares y la formación de colágeno/elastina, al tiempo que reduce el infiltrado de células inflamatorias.
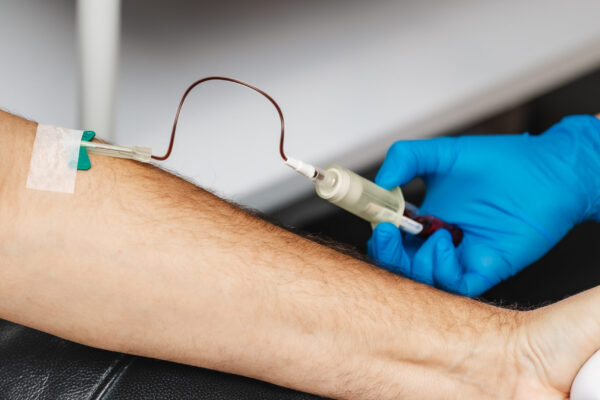
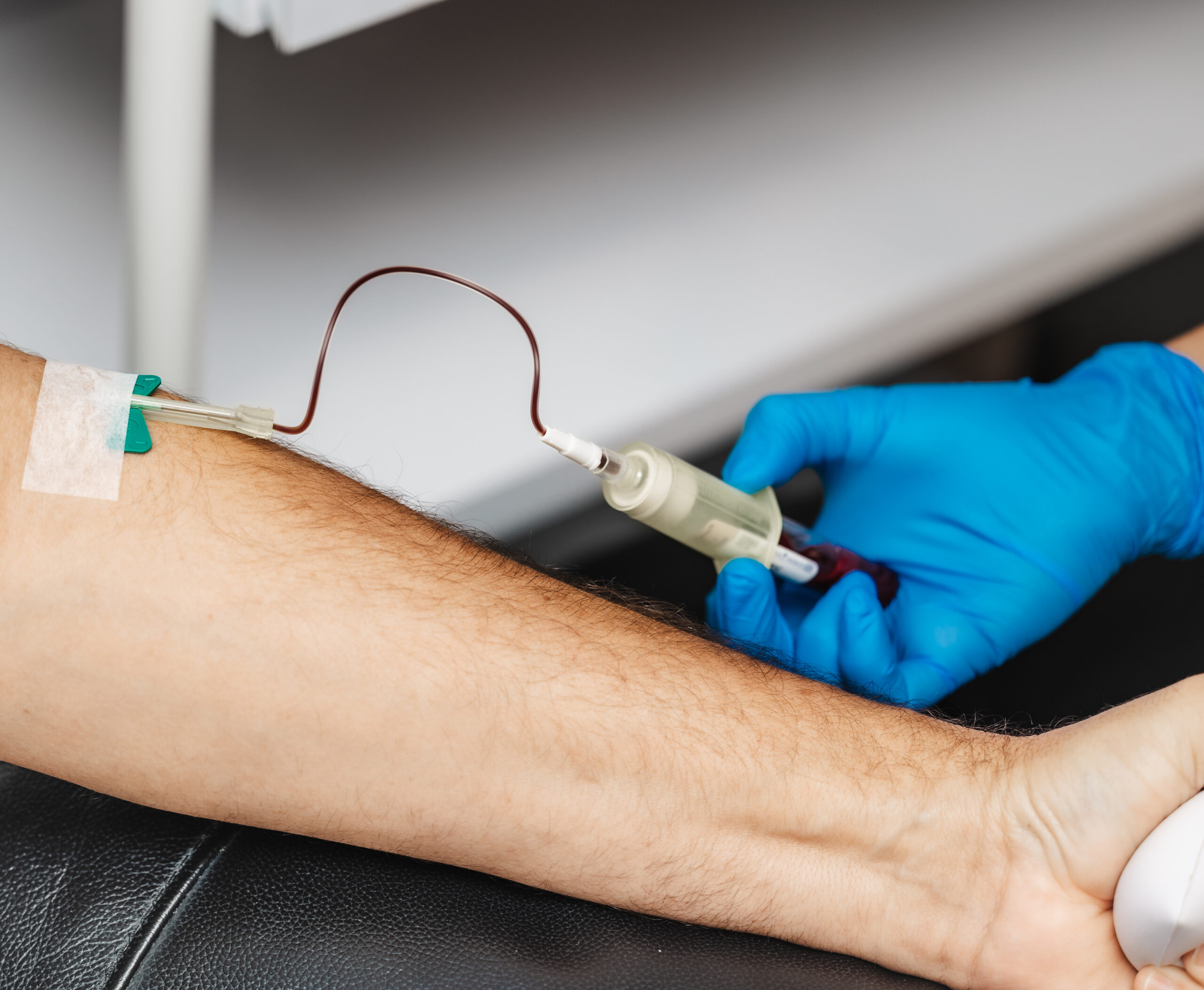
BioXgel se obtiene a partir de un procedimiento sencillo para el paciente, donde se realiza una extracción de sangre que será procesada en el Banco de Células de BioXcellerator con el fin de garantizar las máximas condiciones de bioseguridad. BioXgel es un producto seguro ya que se deriva principalmente de la misma sangre del paciente, por ello es de carácter autólogo y en el proceso de preparación no se involucra el uso de proteínas exógenas como la trombina.
BioXgel se produce a partir de la centrifugación de sangre completa autóloga, obteniendo dicho derivado sanguíneo con una concentración de plaquetas hasta tres veces más rica que lo normal, mediante el uso de kits comerciales o “técnicas internas”, con el objetivo de proporcionar un producto caracterizado por una concentración de plaquetas que se puede utilizar como líquido o en forma de gel activado.
Posterior a la extracción de sangre periférica mediante venopunción, se procede a la centrifugación de sangre para recuperar la fracción enriquecida en plaquetas y estimulación plaquetaria para liberar moléculas bioactivas. BioXgel se obtiene a partir de un volumen entre 50 y 130 mL de sangre total del paciente de acuerdo con la terapia y tipo de aplicación. No necesita de ayunos ni condiciones especiales para el paciente para tomar la muestra. Se recomienda que el procedimiento de toma de sangre y preparación de BioXgel se realice en un periodo no mayor a las 4 horas antes de la intervención quirúrgica o aplicación ambulatoria del mismo. Las condiciones de toma de muestra y preparación de BioXgel permiten mantener la morfología de las plaquetas y no interfieren con la activación plaquetaria al momento de aplicarse el producto. Posteriormente, la muestra de sangre se somete a un proceso estandarizado y controlado de separación molecular según sus características de flotación y densidad. El proceso dura alrededor de 1 hora y media y 2 horas.
El proceso finaliza con la aplicación por vía intradérmica, intralesional o intra-articular, dependiendo del protocolo de atención y de la indicación clínica.
BioXgel plasma autólogo condicionado por 6 mL, 9 mL, 12 mL y 15 mL + Activador iónico suplementado con oligoelementos.
¿Cuando está indicada?



Advertencias y contraindicaciones
Entre las contraindicaciones absolutas del uso de BioXgel están: el síndrome de disfunción plaquetaria, la inestabilidad hemodinámica, pacientes con enfermedad hepática crónica, septicemia, infección local en el sitio de aplicación, hipofibronogenemia y uso de anticoagulantes.
Entre las contraindicaciones relativas están el uso de medicamentos que afectan la secreción de plaquetas, los cuales incluyen los medicamentos antiplaquetarios (clopidogrel, ticagrelor, vorapaxar, entre otros), aspirina, medicamentos antiinflamatorios no esteroideos (AINES) y medicamentos antihistamínicos 48 horas antes del procedimiento, además del uso de esteroides tópicos o sistemáticos un mes antes del procedimiento, tabaquismo, hemoglobina < 10 mg/dL, trombocitopenia < 100000/uL, o enfermedades autoinmunes.
Cuando sea clínicamente apropiado, los pacientes pueden abstenerse de tomar medicamentos por un periodo de tiempo previo a la extracción de sangre, según la farmacodinámica y el perfil farmacocinético de la terapéutica, para reducir los posibles efectos inducidos por los medicamentos sobre el BioXgel. Si se deben evitar los medicamentos que inhiben la función plaquetaria, se recomiendan tres (3) días de abstinencia antes de la toma de la muestra para los medicamentos que inhiben reversiblemente la función plaquetaria, mientras que se recomiendan diez (10) días de abstinencia para los medicamentos que inhiben irreversiblemente la función plaquetaria, según pertinencia e indicación médica.
Los efectos secundarios incluyen:
- Dolor, eritema y/o edema en el sitio de aplicación, los cuales son transitorios de leve a moderados y se resuelven en las primeras 24 a 36 horas después de la aplicación.
- Equimosis, la cual se resuelve espontáneamente en un lapso de una semana.
Con respecto a las complicaciones, el índice de efectos adversos serios a la aplicación de nuestro tratamiento con BioXgel es menor al 1%, y se reducen a infecciones cutáneas menores y reacciones alérgicas e inflamatorias leves que suelen ser autolimitadas.
Las siguientes son algunas de las recomendaciones a seguir si deseas recibir nuestro producto BioXgel para aplicación dermatológica:
- Evitar exponerse a ambientes contaminantes en los días posteriores a la aplicación de BioXgel.
- Evitar el uso de zonas húmedas como piscinas, turcos, saunas, jacuzzi.
- Evitar la sudoración excesiva al realizar actividades deportivas.
- No exponerse al sol directamente (se recomienda el uso de bloqueadores/protectores solares FPS).
Referencias
- Sheth U, Dwyer T, Smith I, Wasserstein D, Theodoropoulos J, Takhar S, et al. Does Platelet-Rich Plasma Lead to Earlier Return to Sport When Compared With Conservative Treatment in Acute Muscle Injuries? A Systematic Review and Meta-analysis. Arthrosc J Arthrosc Relat Surg. 2018;34(1):281-288.e1.
- Boivin J, Tolsma R, Awad P, Kenter K, Li Y. El uso biológico del plasma rico en plaquetas en la reparación y lesión del músculo esquelético. Am J Sports Med. 2021;03635465211061606.
- Kunze KN, Hannon CP, Fialkoff JD, Frank RM, Cole BJ. Platelet-rich plasma for muscle injuries: A systematic review of the basic science literature. World J Orthop. 2019;10(7):278-91.
- Taylor DW, Petrera M, Hendry M, Theodoropoulos JS. A Systematic Review of the Use of Platelet-Rich Plasma in Sports Medicine as a New Treatment for Tendon and Ligament Injuries. Clin J Sport Med. 2011;21(4):344-52.
- Belk JW, Kraeutler MJ, Houck DA, Goodrich JA, Dragoo JL, McCarty EC. Platelet-Rich Plasma Versus Hyaluronic Acid for Knee Osteoarthritis: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Am J Sports Med. 2021;49(1):249-60.
- Souzdalnitski D, Narouze SN, Lerman IR, Calodney A. Platelet-rich plasma injections for knee osteoarthritis: Systematic review of duration of clinical benefit. Tech Reg Anesth Pain Manag. 2015;19(1):67-72.
- Gato-Calvo L, Magalhaes J, Ruiz-Romero C, Blanco F, Fernandez Burguera E. Platelet-rich plasma in osteoarthritis treatment: Review of current evidence. Ther Adv Chronic Dis. 2019;10:204062231982556.
- Kon E, Di Matteo B, Delgado D, Cole BJ, Dorotei A, Dragoo JL, et al. Platelet-rich plasma for the treatment of knee osteoarthritis: an expert opinion and proposal for a novel classification and coding system. Expert Opin Biol Ther. 2020;20(12):1447-60.
- Hohmann E, Tetsworth K, Glatt V. Is platelet-rich plasma effective for the treatment of knee osteoarthritis? A systematic review and meta-analysis of level 1 and 2 randomized controlled trials. Eur J Orthop Surg Traumatol Orthop Traumatol. 2020;30(6):955-67.
- Rodríguez-Merchán EC. Intra-Articular Platelet-Rich Plasma Injections in Knee Osteoarthritis: A Review of Their Current Molecular Mechanisms of Action and Their Degree of Efficacy. Int J Mol Sci. 2022;23(3):1301.
- Meheux C, McCulloch P, Lintner D, Varner K, Harris J. Efficacy of Intra-articular Platelet-Rich Plasma Injections in Knee Osteoarthritis: A Systematic Review. Arthrosc J Arthrosc Relat Surg. 2015;32.
- Yang FA, Liao CD, Wu CW, Shih YC, Wu LC, Chen HC. Effects of applying platelet-rich plasma during arthroscopic rotator cuff repair: a systematic review and meta-analysis of randomised controlled trials. Sci Rep. 2020;10(1):17171.
- Ahmad Z, Ang S, Rushton N, Harvey A, Akhtar K, Dawson-Bowling S, et al. Platelet-Rich Plasma Augmentation of Arthroscopic Rotator Cuff Repair Lowers Retear Rates and Improves Short-Term Postoperative Functional Outcome Scores: A Systematic Review of Meta-Analyses. Arthrosc Sports Med Rehabil. 2022;4(2):e823-33.
- Sethi D, Martin KE, Shrotriya S, Brown BL. Systematic literature review evaluating evidence and mechanisms of action for platelet-rich plasma as an antibacterial agent. J Cardiothorac Surg. 2021;16(1):277.
- Smith O, Kanapathy M, Khajuria A, Prokopenko M, Hachach‐Haram N, Mann H, et al. Systematic review of the efficacy of fat grafting and platelet‐rich plasma for wound healing. Int Wound J. 2017;15.
- Carter MJ, Fylling CP, Parnell LKS. Use of platelet rich plasma gel on wound healing: a systematic review and meta-analysis. Eplasty. 2011;11:e38.
- White C, Brahs A, Dorton D, Witfill K. Platelet-Rich Plasma: A Comprehensive Review of Emerging Applications in Medical and Aesthetic Dermatology. J Clin Aesthetic Dermatol. 2021;14(11):44-57.
- Sawetz I, Lebo PB, Nischwitz SP, Winter R, Schaunig C, Brinskelle P, et al. Platelet-rich plasma for striae distensae: What do we know about processed autologous blood contents for treating skin stretchmarks?-A systematic review. Int Wound J. 2021;18(3):387-95.
- Hesseler MJ, Shyam N. Platelet-rich plasma and its utility in the treatment of acne scars: A systematic review. J Am Acad Dermatol. 2019;80(6):1730-45.
- Kim IS, Park KY, Kim BJ, Kim MN, Kim CW, Kim SE. Efficacy of intradermal radiofrequency combined with autologous platelet-rich plasma in striae distensae: a pilot study. Int J Dermatol. 2012;51(10):1253-8.
- Epifanova MV, Gvasalia BR, Durashov MA, Artemenko SA. Platelet-Rich Plasma Therapy for Male Sexual Dysfunction: Myth or Reality? Sex Med Rev. 2020;8(1):106-13.
- Poulios E, Mykoniatis I, Pyrgidis N, Zilotis F, Kapoteli P, Kotsiris D, et al. Platelet-Rich Plasma (PRP) Improves Erectile Function: A Double-Blind, Randomized, Placebo-Controlled Clinical Trial. J Sex Med. 2021;18(5):926-35.
- Taş T, Çakıroğlu B, Arda E, Onuk Ö, Nuhoğlu B. Early Clinical Results of the Tolerability, Safety, and Efficacy of Autologous Platelet-Rich Plasma Administration in Erectile Dysfunction. Sex Med. 2021;9(2):100313.
- Goldstein AT, Mitchell L, Govind V, Heller D. A randomized double-blind placebo-controlled trial of autologous platelet-rich plasma intradermal injections for the treatment of vulvar lichen sclerosus. J Am Acad Dermatol. 2019;80(6):1788-9.
- Vanaman M, Bolton J, Placik O, Fabi SG. Emerging Trends in Nonsurgical Female Genital Rejuvenation. Dermatol Surg Off Publ Am Soc Dermatol Surg Al. 2016;42(9):1019-29.
- Eshtiaghi P, Sadownik LA. Fact or Fiction? Adipose-Derived Stem Cells and Platelet-Rich Plasma for the Treatment of Vulvar Lichen Sclerosus. J Low Genit Tract Dis. 2019;23(1):65-70.
- Goldstein AT, King M, Runels C, Gloth M, Pfau R. Intradermal injection of autologous platelet-rich plasma for the treatment of vulvar lichen sclerosus. J Am Acad Dermatol. 2017;76(1):158-60.
- Casabona F, Priano V, Vallerino V, Cogliandro A, Lavagnino G. New surgical approach to lichen sclerosus of the vulva: the role of adipose-derived mesenchymal cells and platelet-rich plasma in tissue regeneration. Plast Reconstr Surg. 2010;126(4):210e-1e.